Unidad de Cirugía Hepatobiliopancreática y
Trasplante hepático
Hospital Clínico Universitario Lozano Blesa. Zaragoza
A. ALCANCE Y OBJETIVOS:
La
guía clínica tiene como objetivo fundamental racionalizar el tratamiento de los
pacientes afectos de metástasis hepáticas del carcinoma colo-rectal que por su
pertenencia al Sector Zaragoza III son atendidos en el Hospital Clínico
Universitario Lozano Blesa. La aplicación de la misma se materializará de
manera preferente en el Comité de Tumores Digestivos de este hospital lugar
donde se presentan y discuten los casos clínicos afectos por esta patología.
1. INTRODUCCIÓN.
En el año 2006 hubo 412 900 nuevos casos de cáncer colo-rectal
(CCR) en Europa lo cual supone un 12,9% de todos los cánceres y durante ese
mismo año, el CCR fue responsable de 217.400 muertes. Aproximadamente el 25% se
presentan con metástasis ya en el diagnóstico inicial y entre el 50 y el 60% de
los pacientes con CCR desarrollarán metástasis en el futuro contribuyendo a la
alta mortalidad referida. Históricamente solo entre el 10 y el 15% de los
pacientes con metástasis hepáticas (MH) del CCR eran candidatos a la resección
radical y los pacientes que no se trataban tenían una supervivencia a 5 años
inferior al 1%. Sin embargo en las últimas dos décadas se han producido avances
muy significativos en el diagnóstico por la imagen, en la técnica quirúrgica
hepática, en el manejo anestésico de estos pacientes y en la introducción de
nuevos agentes citotóxicos y biológicos para la quimioterapia pre y postoperatoria.
En la actualidad, con una adecuada selección de pacientes, las posibilidades de
resección de las MH llegan hasta el 40% de los casos y cuando se consigue una
resección R0 cerca del 45% están vivos y libres de enfermedad a los 5 años,
supervivencia que puede llegar al 25% a los 10 años. Avances en otras terapias
como la ablación local de las metástasis mediante instilación de alcohol,
Radiofrecuencia (RF), quimioterapia intraarterial hepática, quimioembolización
o radioterapia ejercen un papel complementario sin poder alcanzar por si solas los
niveles de supervivencia de la cirugía.
No existen estudios prospectivos y aleatorizados que
comparen la resección de las MH con la abstención quirúrgica, sea cual sea la
modalidad de tratamiento alternativo elegido, pero hoy día no es ético plantear
estudios de estas características dada la superioridad de la resección con la
supervivencia demostrada a largo plazo.
El tratamiento de elección de las MH del
CCR es la resección quirúrgica completa de las mismas. Nivel de evidencia 1c
(Grado de recomendación A).
Estos cambios hacen necesaria una actualización de
los estándares que guían el manejo general de los enfermos afectos de MH del
CCR.
Existe menos experiencia y por tanto menor evidencia
de que puedan obtenerse beneficios con la resección en otro tipo de metástasis
como las del carcinoma renal, las neoplasias urogenitales, los tumores
neuroendocrinos o las neoplasias de mama que exigirán una actuación
individualizada según los casos y se escapan del objetivo de esta guía.
Bibliografía
1.1. Bipat S, van Leeuwen MS, Ijzermans JNM, Comans
EFI, Planting ASTh, Bossuyt PMM, Greve JW, Stoker J. Evidence-based guideline
on management of colo-rectal liver metastases in the Netherlands. Neth J Med
2007;65(1):5-14.
1.2. Gallinger S, Biagi JJ, Fletcher GG, Nhan C, Ruo
L, McLeod RS and the Expert Panel. The role of liver resection in colo-rectal
cancer metastases. Toronto (ON): Cancer Care Ontario; 2012 June 15.
Evidence-based Series No.:17-7. http://www.cancercare.on.ca/toolbox/qualityguidelines/clin-program/surgery-ebs/
1.3. King’s College Hospital NHS Foundation Trust.
Hepato-biliary and Pancreatic Service. Clinical guidelines for the management
of patients with colo-rectal liver metastases. July 2010.
1.4. Hospital Universitario
La Fe. Unidad de Cirugía Hepatobiliopancreática y Trasplante. Guía clínica del
tratamiento de las metástasis hepáticas de carcinoma colo-rectal. http://www.ucthlafe.com/doc/guia_
metastasis_hepaticas_carcinoma_colorrectal.pdf
1.5. Van Cutsem E, Nordlinger B, Cervantes A. ESMO
Guidelines Working Group. Advanced colo-rectal cancer: ESMO Clinical Practice
Guidelines for treatment. Ann Oncol 2010;21 (Suppl 5):v93-v97.
1.6. Venook AP, Curley SA, Tanabe
KK, Savarese DMF. Management of potentially resectable colo-rectal cancer liver
metastases. www.uptodate.com 2014.
2. EQUIPOS
MULTIDISCIPLINARIOS.
Hoy
día está bien aceptado que la indicación quirúrgica de las MH del CCR debe
establecerse mediante consenso en el seno de un equipo de Tumores Digestivos
formado por un oncólogo, un radiólogo, un cirujano hepático, un radioterapeuta,
un anatomopatólogo y un especialista en enfermedades hepatobiliares. Por tanto
es obligatorio que las decisiones sobre pacientes con MH del CCR se tomen en el
seno de estos equipos multidisciplinares que funcionan en la mayoría de los
hospitales.
Por
otro lado, en una época en la que se hace especial hincapié en la
centralización de determinadas patologías en servicios quirúrgicos con un alto
volumen de pacientes, es recomendable que las resecciones hepáticas se lleven a
cabo por un equipo quirúrgico entrenado en cirugía hepática. Las resecciones
hepáticas estuvieron gravadas con una mortalidad que podía llegar al 15% de los
casos y una morbilidad entre el 20 y el 40%. En la actualidad estas cifras han
bajado considerablemente y las tasas de mortalidad están por debajo del 5% y
del 20% en cuanto a la morbilidad. Todo ello es debido a un mejor conocimiento de la anatomía
funcional del hígado, a la mejora de las técnicas quirúrgicas y el soporte
anestésico, sin olvidar los importantes avances en instrumentación. Podríamos
decir que aunque no es imprescindible que la resección hepática se haga en
grandes hospitales, parece necesario disponer de unos mínimos requisitos
humanos y técnicos según los estándares actuales que permitan la acreditación
para la práctica de esta cirugía.
La indicación
de resección de las MH de CCR debe establecerse por un equipo multidisciplinar,
siendo recomendable su desarrollo en unidades que cumplan los estándares
actuales. Nivel de evidencia 2a (Grado de recomendación B).
Bibliografía
2.1.
Figueras J, Valls C, Fabregat J, Serrano T, Jaurrieta E. Equipamiento,
experiencia mínima y estándares en la cirugía hepatobiliopancreática. Cir Esp 2002;71(4):201-6.
2.2. Garden OJ, Rees M, Poston GJ, Mirza
D, Saunders M, Ledermann J, Primrose JN, Parks RW. Guidelines for resection of colo-rectal
cancer liver metastases. Gut 2006;55(Suppl.III):iii1-iii8.
2.3. Hospital Universitario
La Fe. Unidad de Cirugía Hepatobiliopancreática y Trasplante. Guía clínica del
tratamiento de las metástasis hepáticas de carcinoma colo-rectal. http://www.ucthlafe.com/doc/guia_
metastasis_hepaticas_carcinoma_colorrectal.pdf
3.
DIAGNÓSTICO DE METASTASIS HEPÁTICAS Y DE OTRAS LOCALIZACIONES.
Las
pruebas de imagen juegan un papel muy importante ya en el momento del
diagnóstico del tumor primario, ante la presencia de posibles metástasis
sincrónicas en hígado y pulmón. Para completar el estudio de extensión del
tumor primario debe realizarse una TC helicoidal toracoabdominal o una Resonancia Magnética
(RM), pruebas con un nivel de seguridad superior a la ecografía. Su realización
es importante no solo para determinar la posible presencia de metástasis
hepáticas sino también para determinar si los pacientes necesitan terapia
adyuvante. El hallazgo de metástasis pulmonares, condición mucho menos prevalente,
puede hacerse también por una TC torácica, pero en presencia de Rx de tórax
normal, su valor adicional es limitado.
Durante
el seguimiento del tumor primario para la detección de metástasis metacrónicas
se recomienda el empleo del CEA como marcador tumoral si se detectó elevación
del mismo en el momento del diagnóstico del tumor colo-rectal. En este
seguimiento el valor de la ecografía como prueba de imagen para detectar
metástasis hepáticas no es inferior al TC helicoidal o a la RM por lo que
debería considerarse como prueba de elección del seguimiento del cáncer de
colon, en cambio el seguimiento del cáncer de recto exige al menos un TC
toracoabdominal anual. En aquellos casos en que la elevación del CEA no sea
explicable por la ecografía o sea preciso valorar la resecabilidad, la TC
helicoidal o la RM deben realizarse. La tomografía por emisión de positrones
(PET) o la prueba híbrida PET-TC no debería realizarse rutinariamente salvo en
caso de imágenes dudosas con la TC y/o RM y en aquellos casos en que se
sospeche la presencia de enfermedad extrahepática o recidiva locoregional. La
búsqueda de metástasis pulmonares metacrónicas suele realizarse con la TC
torácica como exploración adicional a la TC abdominal. Sin embargo la TC
torácica presenta un elevado número de falsos positivos y su valor en presencia
de una Rx de tórax normal es bajo.
No
hay lugar para el empleo rutinario de la laparoscopia como medio diagnóstico de
las metástasis hepáticas o de la enfermedad extrahepática. Sin embargo podría
estar indicada en pacientes con enfermedad primaria muy agresiva en un intento
de identificar metástasis ocultas y así evitar laparotomías innecesarias. El
examen ecográfico del hígado durante la laparoscopia podría aportar información
adicional en pacientes seleccionados.
La
utilización de puntaciones (score) predictivas como el Clinical Risk Score
(CRS) que Fong popularizó en 1999, basado en 5 parámetros: la afectación ganglionar del tumor primitivo, el intervalo entre el
diagnóstico del tumor primario y de las MH, el número de éstas, su diámetro
superior o no a 5 cms y un valor de CEA superior o no a 200 ng/ml, se
consideró útil como sistema predictivo de supervivencia al observar que
pacientes con un CRS entre 0 y 2 mostraban supervivencia a los 5 años
superiores al 50% y en cambio, con un CRS entre 3 y 5 la supervivencia caía por
debajo del 25%. Hoy día, con el empleo rutinario en gran número de casos de quimioterapia
antes de la resección hepática, la mayoría de los cirujanos hepatobiliares han
abandonado su empleo aunque sin duda sigue siendo una buena fuente de
información predictiva.
Una
TC helicoidal toracoabdominal y/o una RM deben realizarse para completar el
estudio de extensión del tumor primario, valorar la resecabilidad de las
posibles MH sincrónicas del CCR y determinar la necesidad de terapia adyuvante.
Nivel de evidencia 4 (Grado de recomendación B).
Si
el hígado no puede evaluarse de manera apropiada mediante ecografía, si se
produce una elevación del CEA inexplicable o en el cáncer de recto, está
indicada la realización de una TC helicoidal toracoabdominal o un RM. Nivel de
evidencia 1 (Grado de recomendación A).
La PET
o la técnica híbrida PET-TAC debe usarse cuando se dispone de tecnología
adecuada y radiólogos expertos para el estudio de lesiones hepáticas dudosas,
sospecha de enfermedad extrahepática o recidiva locoregional. Nivel de
evidencia 3a (Grado de recomendación B).
Bibliografía
3.2. Bipat S, van Leeuwen MS, Ijzermans JNM, Comans
EFI, Planting ASTh, Bossuyt PMM, Greve JW, Stoker J. Evidence-based guideline
on management of colo-rectal liver metastases in the Netherlands. Neth J Med
2007;65(1):5-14.
3.3. Fong Y, Fortner J, Sun RL, Brennan MF, Blumgart
LH. Clinical score for predicting recurrence after hepatic resection for
metastatic colo-rectal cancer: analysis of 1001 consecutive cases. Ann Surg
1999;230(3):309-21.
3.4. Garden OJ, Rees M, Poston GJ, Mirza
D, Saunders M, Ledermann J, Primrose JN, Parks RW. Guidelines for resection of colo-rectal
cancer liver metastases. Gut 2006;55(Suppl.III):iii1-iii8.
3.5. Jeffery GM, Hickey BE, Hider P. Follow-up
strategies for patients treated for non-metastatic colo-rectal carcinoma.
Cochrane Library. Oxford: Update software, 2002.
3.8. Venook AP, Curley SA, Tanabe KK, Savarese DMF.
Management of potentially resectable colo-rectal cancer liver metastases. www.uptodate.com
2014.
4. REQUISITOS
PARA LA RESECCIÓN QUIRÚRGICA.
La
selección óptima de pacientes a ser candidatos para resección de las MH del CCR
está evolucionando. Durante años el estándar ha sido indicar la resección solo
en pacientes con 1 a 3 metástasis unilobares, diagnosticadas preferentemente
después de 12 meses de la exéresis del tumor primario, con márgenes de al menos
1 cm y ausencia de adenopatías hiliares o enfermedad extrahepática. Sin embargo
múltiples estudios han demostrado que la utilización de criterios menos
restrictivos empeora ciertamente el pronóstico pero sigue manteniendo niveles
de supervivencia aceptables. Es por esto por lo que se ha producido un cambio
de paradigma y los límites de la
resecabilidad vienen definidos no por la enfermedad que se extirpa sino por el
remanente hepático futuro.
En la
actualidad existe consenso en declarar como absolutamente contraindicada la
resección en pacientes con enfermedad extrahepática no tratable, afectación de
más del 70% del volumen hepático o más de 6 segmentos y estado general
deficiente. Fuera de estas concretas circunstancias la resección es posible con
las siguientes consideraciones:
-
Ausencia de enfermedad extrahepática. Los pacientes con enfermedad
extrahepática presentan un peor pronóstico en general pero existen
publicaciones que demuestran que la presencia de afectación ganglionar del
hilio hepático y retroportal no debe ser considerada una contraindicación
absoluta pudiendo realizarse una linfadenectomía extensa. La presencia de
depósitos localizados de carcinomatosis, las metástasis en glándula suprarrenal,
ovarios o en el bazo no se consideran contraindicación siempre que se consiga
una resección R0. Con relación a las metástasis pulmonares, se han publicado
largas supervivencias tras su resección en pacientes previamente tratados con
hepatectomías curativas por MH de CCR. No obstante el número de metástasis
pulmonares debe ser limitado, se abordarán tras la resección de las MH y es en
casos de más de 6 metástasis hepáticas cuando se ha visto que el pronóstico es
menos favorable.
-
Número y localización de las metástasis. En la actualidad el límite de la
resección no lo establece el número de las MH o su localización sino el volumen
de hígado remanente tras la hepatectomía. Se considera que en un hígado no
sometido previamente a quimioterapia es suficiente un 30% del volumen hepático remanente
que corresponde generalmente con 2 segmentos. En aquellos casos en los que se
haya aplicado previamente quimioterapia deberá considerarse un mayor volumen
residual. La determinación de la volumetría hepática por TAC resulta
fundamental en estas circunstancias. No obstante, para la mayor parte de los
cirujanos hepáticos, junto a la predicción de un volumen hepático remanente
suficiente, la indicación pasa por descartar previamente por pruebas de imagen
la afectación de la arteria hepática, de los ductos biliares principales, de la
vena porta o de los ganglios celiacos o paraaórticos.
- Márgenes
de resección. En estudios tradicionales se demostraba la necesidad de un margen
de resección de 10 mm para obtener una supervivencia a los 5 años en torno al
45%, produciéndose un deterioro importante de la misma cuando no se alcanzaba
esta distancia. Estudios más actuales no encuentran diferencia en esta
supervivencia siempre y cuando el margen de resección no sea inferior a 1 mm o
se encuentre afectación del mismo.
- Momento de la resección hepática en
pacientes con MH sincrónicas. Estos pacientes presentan peor pronóstico que los
afectados de MH metacrónicas. Sin embargo su presencia no contraindica la
cirugía aunque es controvertido el momento en que debe aplicarse. En principio
la resección simultánea se ha
desaconsejado debido al alto número de complicaciones postoperatorias y a que
un intervalo de 2 ó 3 meses entre la resección del tumor primario y las MH no
incrementa el riesgo de irresecabilidad y en cambio permite detectar respuestas
biológicas agresivas del tumor que desaconsejen la resección hepática. No obstante
la resección simultanea del tumor primario y de las MH podría realizarse en un solo
tiempo siempre y cuando no se precise una resección hepática mayor, es decir 3
o más segmentos. Sería el caso de pacientes con 4 ó menos metástasis que ocupan
menos de 3 segmentos y todas en el mismo lóbulo. Casos favorables para la
resección simultánea son los tumores primitivos que asientan en colon derecho
con metástasis hepáticas sincrónicas, al poder asociar una hemicolectomía
derecha a la resección de las metástasis hepáticas mediante cirugía hepática
menor y de manera excepcional, cirugía hepática mayor.
La
resección secuencial, es decir del tumor primario inicialmente y
posteriormente la cirugía hepática, debería contemplar quimioterapia
neoadyuvante antes de la resección hepática si concurren dos o más factores de
mal pronóstico en el paciente como son: cirugía urgente del tumor primario,
tumor primitivo de más de 10 cms, enfermedad extrahepática resecable, más de 4
metástasis hepáticas, disposición bilobar de estas metástasis, CEA > 50
ng/ml, metástasis pulmonares que no contraindican la resección y recaída
locoregional.
Otra estrategia es el empleo de la llamada cirugía inversa. Está basada en el
hecho de que pacientes con múltiples y grandes MH sincrónicas del CCR, con
tumor primario asintomático, presentan un elevado riesgo de que su enfermedad
hepática progrese todavía más mientras se lleva a cabo el tratamiento del CCR,
especialmente si se producen complicaciones postoperatorias. Se ha propuesto en
este caso la realización de quimioterapia sistémica en primer lugar, basada en
esquemas con 5-fluorouracilo, oxaliplatino y/o irinotecan y fármacos
biológicos, que proporcionan una buena respuesta hepática en cerca del 70% de los casos. Si es así, después de 2-3
meses (4 a 6 ciclos) se hará la reevaluación y la volumetría hepática dirá si
es posible la resección hepática en un tiempo o hay que recurrir a estrategias
de hepatectomías en 2 tiempos. La resección del tumor primario se llevaría a
cabo de 3 a 8 semanas después de la cirugía hepática. Si no existe respuesta
una terapia agresiva debe evitarse y solo se hará tratamiento paliativo.
Estas tres estrategias de resección son
equivalentes en términos de supervivencia media, morbilidad y mortalidad. Su
empleo no deben ser competitivo sino que cada una de ellas deberá adaptarse a
la extensión de la enfermedad y los síntomas que provoca, permitiendo dar a
cada paciente un trato personalizado en un afán de encontrar el tratamiento
óptimo.
- La
edad avanzada en pacientes con buena función cardiopulmonar no será una
contraindicación para la resección de las MH del CCR. En pacientes por encima
de los 70 años la media de supervivencia es de 33 meses y a los 5 años
sobreviven el 22%. En casos de hepatopatía crónica con MELD de 10 o menor y
resección de no más de 2 segmentos es poco probable la aparición de
insuficiencia hepática tras la resección.
Las
MH del CCR deben definirse como resecables cuando la enfermedad puede
extirparse en su totalidad, respetando al menos dos segmentos adyacentes cuyo volumen
sea funcionalmente suficiente. Nivel de evidencia 2a (Grado de recomendación
B).
No
es una contraindicación absoluta de resección la presencia de enfermedad
extrahepática. Nivel de evidencia 2b (Grado de recomendación B).
Se
recomienda un margen de resección suficiente en torno a 10 mm pero márgenes
inferiores no suponen ya un criterio de exclusión. Nivel de evidencia 2b (Grado
de recomendación B).
Ante
la presencia de MH sincrónicas parece recomendable cirugía en un solo tiempo
del tumor primario y de las metástasis cuando la resección hepática sea una
resección menor. En caso contrario se recomienda la resección hepática 6 u 8 semanas después de la resección del
tumor primario. Nivel de evidencia 2c (Grado de recomendación B).
La
edad avanzada no es una contraindicación de resección de las MH del CCR siempre
y cuando el paciente mantenga una buena función cardiopulmonar. Nivel de
evidencia 3a (Grado de recomendación B).
Bibliografía
4.1.
Abad A, Figueras J, Valls C, Carrato A, Pardo F, Díaz-Rubio E, Aranda E.
Guidelines for the detection and treatment of liver metastases of colorectal
cancer. Clin Transl Oncol 2007; 9:723-730.
4.2. Brand MI, Saclarides
TJ, Dobson HD, Millikan KW. Liver resection for colo-rectal cáncer: liver
metastases in the aged. Am Surg 2000;66(4):412-5.
4.3. Brouquet A, Mortenson MM,
Vauthey JN, Rodriguez-Bigas MA, Overman MJ, Chang GJ, Kopetz S, Garrett C,
Curley SA, Abdalla EK. Surgical strategies for synchronous colo-rectal liver metastases in 156 consecutive patients:
classic, combined or reverse strategy? J Am Coll Surg 2010;210(6):934-41.
4.5. Elias D, Ouellet JF,
Bellon N, Pignon JP, Pocard M, Lasser P. Extrahepatic disease does not
contraindicate hepatectomy for colo-rectal liver metastases. Br J Surg 2003;90(5):567-574.
4.6. Garden OJ, Rees M, Poston GJ, Mirza
D, Saunders M, Ledermann J, Primrose JN, Parks RW. Guidelines for resection of colo-rectal
cancer liver metastases. Gut 2006;55(Suppl.III):iii1-iii8
4.7. Hospital Universitario
La Fe. Unidad de Cirugía Hepatobiliopancreática y Trasplante. Guía clínica del
tratamiento de las metástasis hepáticas de carcinoma colo-rectal. http://www.ucthlafe.com/doc/guia_
metastasis_hepaticas_carcinoma_colorrectal.pdf
4.8. Jaeck D. The
significance of hepatic pedicle lymph nodes metastases in surgical management
of colo-rectal liver metastases and of other liver malignancies. Ann Surg Oncol
2003;10(9):1007-11.
4.9. Martin RC 2nd, Augenstein V, Reuter NP, Scoggins CR,
McMasters KM . Simultaneous versus staged resection for synchronous colo-rectal
cancer liver metastases. J Am Coll Surg 2009;208(5):842-52.
4.10. Mentha G, Majno PE, Andres A, Rubbia-Brandt L, Morel P, Roth AD.
Neoadjuvant chemotherapy and resection of advanced synchronous liver metastases
before treatment of the colo-rectal primary. Br J Surg 2006;93(7):872-8.
4.11. Pawlik TM, Scoggins
CR, Zorzi D, Abdalla EK, Andres A, Eng C, Curley SA, Loyer EM, Muratore A,
Mentha G, Capussottti L, Vauthey JN. Effect of surgical margin status on
survival and site of recurrence after hepatic resection for colo-rectal
metastases. Ann Surg 2005;241(5):715-724.
4.12. Pulitanò C, Bodingbauer M, Aldrighetti L, de Jong MC, Castillo F, Schulick RD, Parks RW, Choti MA, Wigmore SJ, Gruenberger T, Pawlik TM. Liver
resection for colo-rectal metastases in presence of extrahepatic disease:
results from an international multi-institutional analysis. Ann Surg Oncol 2011; 18(5):1380-8.
4.13. Tanaka K, Shimada
H, Matsuo K, Nagano Y, Endo I, Sekido H, Togo S.. Outcome after simultaneous colo-rectal and
hepatic resection for colo-rectal cancer with synchronous metastases. Surgery
2004;136(3):650-9.
4.14. Venook AP, Curley SA, Tanabe KK, Savarese DMF.
Management of potentially resectable colo-rectal cancer liver metastases. www.uptodate.com
2014.
4.15. Yin
Z, Liu C, Chen YJ, Bai Y, Shang CZ, Yin RY, Yin D, Wang J. Timing of
hepatectomy in resectable synchronous colo-rectal liver metastases (SCRLM):
Simultaneous or delayed?. Hepatology 2013;57(6):2346-57.
5. TÉCNICAS
PARA MEJORAR LA RESECABILIDAD HEPÁTICA.
En pacientes en los que la resecabilidad de la
enfermedad hepática resulta imposible por el volumen de las MH, su número y
bilateralidad, la localización o el escaso volumen de hígado remanente, es
posible aplicar una serie de técnicas para intentar convertir la enfermedad
hepática en resecable.
- Quimioterapia de
conversión. Los pacientes en los que se detectan MH del CCR consideradas
técnicamente irresecables por su número, tamaño, compromiso ejes vasculares
principales o volumen hepático remanente por debajo del 30%, pueden
beneficiarse de una quimioterapia de conversión, en un intento de conseguir un downstaging tumoral y convertir la
enfermedad hepática en resecable. Incluso según recomienda el panel del
European Colo-rectal Metastases Treatment Group, en el ensayo EORTC 40983, la
quimioterapia previa a la cirugía debería recomendarse para la mayoría de los
pacientes con metástasis hepáticas independientemente del estatus inicial de
resecabilidad. La duración de esta quimioterapia debe ser limitada y deberá
estar marcada por la toxicidad hepática y por la presencia de una respuesta
radiológica completa. En la mayoría de los estudios se recomienda no sobrepasar
los 6 ciclos e incluso se recomienda adelantar la cirugía si se demuestra por
técnicas de imagen haber convertido la enfermedad hepática en resecable. Los
esquemas más utilizados en primera línea son los FOLFOX (5-fluouracilo, ácido
folínico y oxaliplatino) o FOLFIRI (5-fluouracilo, ácido folínico e irinotecan)
consiguiéndose rescatar entre un 15 y un 36% de los enfermos, porcentaje
susceptible de incrementarse con el empleo de anticuerpos monoclonales tipo
cetuximab, panitumumab (estos dos agentes biológicos frente al receptor del
factor de crecimiento epidermal, EGFR, en pacientes con un gen RAS
nativo-wild-type) o bevacizumab (agente biológico activo frente al factor de
crecimiento endotelial vascular, VEGF, utilizable independientemente del estado
del gen RAS).
La cirugía
debería programarse unas 4 semanas después de finalizar la quimioterapia ó 6-8
semanas en caso de haber utilizado bevacizumab. Ante la demostrada presencia de
células tumorales viables, se deberían incluir en la resección todas las
lesiones hepáticas incluso aquellas con respuesta radiológica completa (RRC),
siempre y cuando sea técnicamente factible y quede suficiente hígado
remanente. Cuando una lesión con RRC
quede incluida en el hígado que no se va a resecar la cirugía sigue siendo una
opción razonable si todas las demás lesiones son resecadas. La quimioterapia
postoperatoria deberá seguir a la cirugía hasta completar, en total, 12 ciclos
de tratamiento, con un seguimiento muy estrecho de los pacientes ante la
posible recurrencia de las lesiones.
- Embolización portal. Aunque el mecanismo por el
que se produce todavía no es bien conocido, la redistribución del flujo portal
supone una atrofia del lóbulo embolizado y una hipertrofia del hígado
remanente. Esta embolización puede practicarse por vía percutánea y emplea
distintos materiales como lipiodol, cianoacrilato o partículas PVA (Polyvinyl
alcohol particles) con coils. La
hipertrofia hepática puede suponer un incremento entre un 10 y un 40% del
volumen, por lo que la mejora del volumen hepático remanente convierte a
algunos pacientes con MH en resecables. El tiempo a trascurrir entre la
embolización portal y la cirugía se mueve en un rango de 15 a 45 días, aunque
deberán ser los sucesivos controles volumétricos hepáticos los que marquen el
tiempo óptimo para la resección. Una reciente revisión cifra el éxito clínico
en un 96%, detallando que en un 3,9% la hipertrofia no se produjo, en un 2,8%
fue insuficiente, en un 6,1% se produjo progresión de las metástasis durante el
periodo antes de la cirugía y se registraron un 2,5% de complicaciones mayores.
Estaría indicada en pacientes cuyo hígado remanente sea inferior al 20%, o al
30% si ha recibido quimioterapia o al 40% en hígados con fibrosis o cirrosis.
- Hepatectomía en 2 tiempos. Se trata de una
combinación de dos resecciones hepáticas secuenciales para obtener una
resección R0, circunstancia que sería imposible de conseguir en una sola
operación. El éxito de esta actuación está en la regeneración que sufra el
hígado tras el primer tiempo quirúrgico. Las estrategias utilizadas son las
siguientes:
a. Hepatectomía en 2 tiempos sin embolización portal
y con quimioterapia sistémica entre ambos tiempos quirúrgicos. En el primer
tiempo se resecaran el mayor número posible de metástasis de ambos lóbulos.
Tras la recuperación se someterá al paciente a quimioterapia para evitar la
progresión de la enfermedad. Por lo general se precisa un largo periodo de
tiempo para conseguir la hipertrofia hepática y conseguir realizar la resección
R0 en un segundo tiempo.
b. Hepatectomía en 2 tiempos con embolización
portal. Parece la mejor opción para las metástasis múltiples en ambos lóbulos.
En el primer tiempo quirúrgico se llevaría a cabo una resección no anatómica de
las metástasis accesibles procediendo a una ligadura de la vena porta derecha
en el mismo acto o a una embolización portal percutánea a las 2 semanas de la primera
cirugía. Trascurridos de 2 a 3 meses se realizaría en el segundo tiempo
quirúrgico la hepatectomía derecha clásica o ampliada si se demuestra la
hipertrofia hepática y la ausencia de progresión tumoral.
c. Transección
hepática in situ con ligadura portal y resección en 2 tiempos. En el primer
tiempo de esta nueva estrategia se procede a la ligadura portal derecha
preservando el aporte arterial y los ductos biliares y se llevaba a cabo una
transección hepática dejando el hígado in situ. Puede asociarse alguna
resección atípica de metástasis del hígado izquierdo. Parece demostrarse que
esta técnica favorece una más rápida hipertrofia del hígado con flujo portal y
que la transección hepática previene el crecimiento tumoral en este hígado.
Transcurridas de 2 a 3 semanas y tras comprobar una hipertrofia hepática
suficiente y ausencia de progresión tumoral se procede a completar la hepatectomía
derecha clásica o ampliada.
- Terapias ablativas locales. Son terapias cuyo
objetivo es la destrucción tumoral mediante la aplicación de calor como la
Radiofrecuencia o el Laser, la aplicación de frío, crioterapia, o la inyección
de alcohol, que han demostrado su eficacia ante MH pero en ningún caso superan
a la resección quirúrgica. La Radiofrecuencia intraoperatoria o postoperatoria
puede complementar a una cirugía incompleta por la localización de alguna
metástasis o por lo comprometido de resecciones hepáticas más amplias e incluso
se ha descrito para tratar enfermedad extrahepática localizada.
La Radiofrecuencia, que es la técnica más segura y
con más estudios publicados, presenta también un papel prometedor en pacientes
con MH de CCR no aptos para la cirugía por sus comorbilidades, o en los que
rechazan la cirugía, o en los que se ha conseguido un downstaging tumoral pero siguen siendo irresecables. Sin embargo no
está demostrado que su empleo prolongue la supervivencia en pacientes con
enfermedad extensa.
El empleo de
radioterapia externa o radioterapia selectiva interna (SIRT) mediante el uso de
microesferas marcadas con Yrio 90 para el control de MH del CCR carece de
evidencia científica para poder recomendar su uso por el momento. Serán
necesarios estudios amplios para conocer su potencial como terapia ablativa local
complementaria a la cirugía o sustitutiva de la misma en algunos casos.
- Quimioterapia
intraarterial hepática. Pese a que la utilización de esta técnica tiene más de
40 años tan solo existen publicaciones procedentes del Memorial Sloan Kettering
de New York que muestran buen control local de las MH en pacientes
seleccionados y supervivencias prolongadas. Se han utilizado esquemas basados
en la fluorodeoxyuridina a través de la arteria hepática junto con oxaliplatino
e irinotecan por vía sistémica y también oxaliplatino por vía arterial junto a
5-fluouracilo y leucovorin sistémicos. Esta técnica resulta compleja, con
potencial morbilidad, elevada toxicidad y sus resultados son controvertidos por
lo que su empleo en casos de metástasis hepáticas irresecables como
neoadyuvancia no se ha extendido fuera de Nueva York y no se incluye en ninguna
guía clínica actualmente.
La efectividad de la quimioterapia de
conversión en pacientes en MH de CCR irresecables es dispar y aunque los
esquemas óptimos no se han establecido aún, parece que esquemas basados en la
combinación 5-fluouracilo, ácido folínico y oxaliplatino o irinotecan y agentes
biológicos, pueden inducir una respuesta suficiente para convertir la
enfermedad hepática en resecable. Nivel de evidencia 3 (Grado de recomendación
C).
La embolización portal como mecanismo de
hipertrofia del hígado remanente para favorecer la resección de las MH del CCR,
en pacientes previamente irresecables, ha demostrado sus resultados favorables
en términos de éxito y complicaciones. Nivel de evidencia 3 (Grado de
recomendación C).
La hepatectomía en dos tiempos,
combinada con la ligadura o la embolización portal derecha permite la resección
de las MH del CCR en pacientes en los que es imposible la resección R0 en un
solo tiempo. Nivel de evidencia 3 (Grado de recomendación C).
La Radiofrecuencia es la técnica
ablativa local más prometedora como complemento de la cirugía o como terapia
aislada o asociada a quimioterapia en casos no aptos para cirugía. No se ha
demostrado sin embargo que prolongue la supervivencia media en pacientes con
enfermedad extensa. Nivel de evidencia 3 (Grado de recomendación C).
Bibliografía
5.1. Bipat S, van Leeuwen MS, Ijzermans JNM, Comans
EFI, Planting ASTh, Bossuyt PMM, Greve JW, Stoker J. Evidence-based guideline
on management of colo-rectal liver metastases in the Netherlands. Neth J Med
2007;65(1):5-14.
5.2. Bischof DA, Clary BM,Maithel SK, Pawlik TM.
Surgical management of disappearing colo-rectal liver metastases. Br J Surg
2013;100(11):1414-20.
5.3. Gallinger S, Biagi JJ, Fletcher GG, Nhan C, Ruo
L, McLeod RS and the Expert Panel. The role of liver resection in colo-rectal
cancer metastases. Toronto (ON): Cancer Care Ontario; 2012 June 15.
Evidence-based Series No.:17-7. http://www.cancercare.on.ca/toolbox/qualityguidelines/clin-program/surgery-ebs/
5.4. Garden OJ, Rees M, Poston GJ, Mirza
D, Saunders M, Ledermann J, Primrose JN, Parks RW. Guidelines for resection of colo-rectal
cancer liver metastases. Gut 2006;55(Suppl.III):iii1-iii8
5.5. Hospital Universitario
La Fe. Unidad de Cirugía Hepatobiliopancreática y Trasplante. Guía clínica del
tratamiento de las metástasis hepáticas de carcinoma colo-rectal. http://www.ucthlafe.com/doc/guia_
metastasis_hepaticas_carcinoma_colorrectal.pdf
5.6. Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E, Ferrara N, Fyfe G, Rogers B, Ross R, Kabbinavar F. Bevacizumab plus irinotecan, fluorouracil, and
leucovorin for metastatic colo-rectal cáncer. N Engl J Med
2004;350(23):2335-42.
5.8. Knoefel WT, Gabor I, Rehders A, Alexander A,
Krausch M, Schulte am Esch J, Fürst G, Topp SA. In situ liver transection with
portal vein ligation for rapid growth of the future liver remnant in two-stage
liver resection. Br J Surg 2013;100(3):388-94.
5.9. Masi
G, Loupakis
F, Pollina
L, Vasile
E, Cupini
S, Ricci
S, Brunetti
IM, Ferraldeschi
R, Naso
G, Filipponi
F, Pietrabissa
A, Goletti
O, Baldi
G, Fornaro
L, Andreuccetti
M, Falcone
A. Long-term outcome of initially unresectable metastatic
colo-rectal cancer patients treated with 5-fluorouracil/leucovorin,
oxaliplatin, and irinotecan (FOLFIRI) followed by radical surgery of
metastases. Ann Surg 2009;249(3):420-5.
5.10. Narita M, Oussoultzoglou E, Jaeck D, Fuchschuber
P, Rosso E, Pessaux P, Marzano E, Bachellier P. Two-stage hepatectomy for
multiple bilobar colo-rectal liver metastases. Br J Surg 2011;98(10):1463-75.
5.11. Schnitzbauer AA, Lang SA, Goessmann H, Nadalin S,
Baumgart J, Farkas SA, Fichtner-Feigl S, Lorf T, Goralcyk A, Hörbelt R, Kroemer
A, Loss M, Rümmele P, Scherer MN, Padberg W, Königsrainer A, Lang H, Obed A,
Schlitt HJ. Right portal vein ligation combined with in situ splitting induces
rapid left lateral liver lobe hypertrophy enabling 2-stage extended right
hepatic resection in small-for-size settings. Ann Surg 2012;255(3):405-14.
5.12. Tanaka K, Takakura H, Takeda K, Matsuo K, Nagano
Y, Endo I. Importance of complete pathologic response to prehepatectomy
chemotherapy in treating colo-rectal cancer metastases. Ann Surg
2009;250(6):935-42.
5.13. Van Cutsem E, Nordlinger B, Cervantes A. ESMO
Guidelines Working Group. Advanced colo-rectal cancer: ESMO Clinical Practice
Guidelines for treatment. Ann Oncol 2010;21 (Suppl 5):v93-v97.
5.14. van Lienden KP, van den Esschert JW, de Graaf W, Bipat S, Lameris
JS, van Gulik TM, van Delden OM. Portal vein embolization before liver
resection: A systematic review. Cardiovasc Intervent Radiol 2013;36(1):25-34.
5.15. Venook AP, Curley SA, Tanabe KK, Savarese DMF. Management
of potentially resectable colo-rectal cancer liver metastases. www.uptodate.com
2014.
6. RESECCIONES
REPETIDAS POR RECURRENCIA DE LAS METÁSTASIS.
La recurrencia puede ocurrir hasta en el 60% de los
pacientes sometidos a resección de las MH del CCR y en un 20% de ellos esta
recurrencia vuelve a ser exclusivamente hepática. En su gran mayoría tiene
lugar en los 2 primeros años tras la cirugía. Pese a la mayor dificultad
quirúrgica, la morbimortalidad publicada resulta similar a la de la primera
hepatectomía y la supervivencia a largo plazo es parecida. Por ello en
pacientes sin enfermedad extrahepática y con buen estado general está indicada
una segunda resección hepática. Se consideran como factor favorable un
intervalo libre entre las dos resecciones de más de un año y como desfavorables
el carácter de metástasis sincrónicas en la primera resección y la presencia de
múltiples metástasis al producirse la recidiva.
Ante estas
circunstancias parece lógico establecer un criterio de seguimiento estricto en
estos enfermos. Aunque hay una escasa evidencia sobre la estrategia de
seguimiento a plantear, parece recomendable hacerlo cada 3 meses los 2 primeros
años y cada 6 meses los 3 años siguientes. En cada revisión se recomienda,
además del examen clínico, la determinación del CEA y una TAC toracoabdominal.
Es posible
considerar una nueva resección hepática tras recidiva de las MH del CCR, con indicaciones
similares a la primera resección, en ausencia de enfermedad extrahepática y con
buen estado general del paciente. Nivel de evidencia 3 (Grado de
recomendación C).
Bibliografía
6.1. Bipat S, van Leeuwen MS, Ijzermans JNM, Comans
EFI, Planting ASTh, Bossuyt PMM, Greve JW, Stoker J. Evidence-based guideline
on management of colo-rectal liver metastases in the Netherlands. Neth J Med
2007;65(1):5-14.
6.2. Jones RP, Jackson R, Dunne DFJ, Malik HZ, Fenwick
SW, Poston GJ, Ghaneh P. Systematic review and meta-analysis of follow-up after
hepatectomy for colo-rectal liver metastases. Br J Surg 2012;99(4):477-86.
6.3. Shaw IM, Rees M, Welsh FKS, Bygrave S, John TG.
Repeat hepatic resection for recurrent colo-rectal liver metastases is
associated with favourable long-term survival. Br J Surg 2006;93(4):457-64.
6.4. Venook AP, Curley SA, Tanabe KK, Savarese DMF. Management
of potentially resectable colo-rectal cancer liver metastases. www.uptodate.com
2014.
7.
ESTUDIO ANATOMOPATOLÓGICO DEL HÍGADO RESECADO.
El informe
anatomopatológico debe incluir detalles específicos que son necesarios para
determinar el pronóstico, haciendo referencia además, de manera precisa, al
efecto del tratamiento quimioterápico neoadyuvante sobre el hígado no tumoral y
al grado de regresión conseguido en el tejido tumoral. Nos guiaremos de las
recomendaciones del The Royal College of Pathologists publicado
en 2007 y de las recomendaciones de consenso de la Sociedad Española de
Anatomía Patológica del 2014:
Descripción
macroscópica:
.Tipo de espécimen (listado segmentos
hepáticos recibidos, localización de las resecciones no anatómicas)
.Peso del espécimen recibido
.Dimensiones del espécimen
.Número de lesiones presentes
.Presencia de lesiones satélites
.Diámetro de las lesiones
.Distancia del borde de resección a la lesión
más próxima
.Posible afectación de la cápsula hepática
.Posible invasión de tejido adyacente al
hígado
.Presencia de ganglios en la pieza
Descripción
microscópica:
.Diferenciación del tumor: G1, G2, G3
.Crecimiento: Expansivo, infiltrante
.Bien delimitado no encapsulado, encapsulado
intacto o infiltrado, pseudoencapsulado
.Borde quirúrgico de resección: Libre a (mm)
del tumor, infiltrado
.Invasión (si/no): Linfovascular, biliar,
perineural, sinusoidal
.Porcentaje de ganglios con metástasis
Grado
de regresión tumoral (% de células tumorales en cada nódulo):
.I- Respuesta completa (0%)
.II- Células aisladas pequeños grupos (1-10%)
.III- Menos de la mitad del volumen tumoral
inicial (11-50%)
.IV- Respuesta mínima, extenso tumor residual
(>50%)
%
Fibrosis, % Necrosis, % Mucina
.Medida de zona periférica de la metástasis
interfase tumor tejido normal (ITN) … cm
Lesiones
post tratamiento en parénquima no tumoral:
.Esteatosis: Grado I (0-30%) Grado II (30-60%) Grado III (>60%)
.Esteatohepatitis: - Actividad inflamatoria: I II III IV
-
Fibrosis: I II III IV
.Lesiones relacionadas con el síndrome de
obstrucción sinusoidal (SOS):
1. Dilatación
sinusoidal centrolobulillar: Leve (1/3 lobulillo), Moderada (2/3), Grave (todo
el lobulillo)
2. Fibrosis
central / perisinusoidal: Ausente, Leve (<50 moderada="" sinusoides="" venas="" y="">50%)
3. Hiperplasia
nodular regenerativa: Ausente, Leve, Moderada, Grave
El informe anatomopatológico de la
resección de MH del CCR debe incluir el número, tamaño y localización de las
metástasis, posible afectación del margen de resección, de la cápsula, grado de
diferenciación tumoral, presencia de necrosis, afectación vascular o linfática
y posible afectación de ganglios si se han extirpado. Nivel de evidencia 5 (Grado de recomendación
D).
Bibliografía
7.1. Garden
OJ, Rees M, Poston GJ, Mirza D, Saunders M, Ledermann J, Primrose JN, Parks RW.
Guidelines for
resection of colo-rectal cancer liver metastases. Gut
2006;55(Suppl.III):iii1-iii8
7.2. Gómez-Dorronsoro M, Miquel R, Ortega L,
Hörndler C, Antúnez JR, Villar-Pastor CM, Vera R, Plaza C, García M, Díaz E,
Ortiz RM, Pérez J, Pereira S, López-Rios F y González-Cámpora R. Recomendaciones para el estudio
patológico de las metástasis hepáticas de cáncer colorrectal tras
neoadyuvancia. Consenso Nacional de la Sociedad Española de Anatomía
Patológica. Rev Esp Patol 2014;47(2):90-98.
7.3. Rubbia-Brandt L, Giostra E, Brezault C, Roth AD, Andres A, Audard
V, Sartoretti P, Dousset B, Majno PE, Soubrane O, Chaussade S, Mentha G, Terris
B. Importance of histological tumor response assessment in predicting the outcome
in patients with colo-rectal liver metastases treated with neo-adjuvant chemotherapy
followed by liver surgery. Ann Oncol 2007;18(2):299–304.
7.4. Wyatt JI, Hubscher SG, Goldin RD. Dataset for histopathology
reporting of liver resection specimens (including gall bladder) and liver
biopsies for primary and metastatic carcinoma (2nd edition). The Royal College
of Pathologists. 2012. http://www.rcpath.org/Resources/ RCPath/Migrated%20Resources/
Documents/ G/G050_LiverDataset_Jun12.pdf
8.
ALGORITMOS TERAPÉUTICOS.
Las
estrategias expuestas en los apartados anteriores se plasman en los siguientes
algoritmos terapéuticos:
-PACIENTES
CON MH SINCRÓNICAS
-PACIENTES
CON MH METACRÓNICAS
B. PARTICIPACIÓN DE LOS GRUPOS PROFESIONALES
IMPLICADOS:
La guía ha sido elaborada por la Sección
Hepatobiliopancreática y Trasplante hepático del Servicio de Cirugía General y
sometida a la consideración de los grupos profesionales que participan en el
Comité de Tumores Digestivos del Hospital Clínico Universitario Lozano Blesa.
Estos profesionales son considerados los auténticos usuarios de la guía y pertenecen
a los siguientes servicios:
- Servicio de
Cirugía General -
Servicio de Oncología Médica
- Servicio de Digestivo - Servicio de Oncología
Radioterápica
- Servicio de Radiología -
Servicio de Anatomía Patológica
La guía está siendo probada por la Sección
Hepatobiliopancreática y Trasplante hepático que simultáneamente ha elaborado
una base de datos con casi 150 variables que incluye todos los pacientes
intervenidos de MH del CCR, en una primera fase, desde el año 2010 a la
actualidad, pero con el deseo de recopilar datos de años previos al objeto de
obtener una mayor casuística. Esta recogida retrospectiva de información es
complementaria a la recogida prospectiva que se está haciendo de los pacientes
que se operan desde que la base de datos está activa a comienzos del 2014.
C. CRITERIOS DE ELABORACIÓN
La estrategia de búsqueda de la evidencia existente
se ha llevado a cabo utilizando como términos:
- Colo-rectal liver metastases. Diagnosis and
treatment
- Colo-rectal liver metastases. Guidelines.
La búsqueda se ha realizado de manera preferente
utilizando las bases electrónicas MEDLINE, Cochrane Library, National
Comprehensive Cancer Network y UptoDate:
http://www.thecochranelibrary.com/view/0/index.html
Con los conocimientos aportados por la revisión
hemos procedido elaborar de manera escueta los diversos apartados
(introducción, equipos multidisciplinarios, estrategia diagnóstica, etc), de
tal modo que al final de cada uno se recogen las aportaciones más relevantes
con los niveles de evidencia de los que se dispone, su grado de recomendación y
la bibliografía empleada. Para establecer los niveles de evidencia y los grados
de recomendación hemos seguido la división empleada por el CEBM, Centre for
Evidence-Based Medicine de Oxford (http://www.cebm.net/).
Esta guía, una vez aprobada en el Comité de Tumores
Digestivos será presentada al Comité de
Evaluación de Guías Clínicas para su revisión externa.
Se establece como cronograma más apropiado la
posibilidad de incorporar de manera anual aportaciones relevantes
que puedan modificar de manera significativa las recomendaciones de la guía sin
que modifiquen de manera sustancial su contenido y revisiones más
exhaustivas cada 3 años que deberán ser evaluadas nuevamente por el
correspondiente Comité de Evaluación de Guías de Práctica Clínica.
D. APLICABILIDAD
La guía puede ser aplicada desde el mismo momento de
su difusión dado que su elaboración se ha llevado a cabo con el consenso del
Comité de Tumores Digestivos, auténticos usuarios de la misma, y no supone
cambio alguno en la actual organización asistencial.
En cuanto a las recomendaciones que la guía recoge
no suponen consumo de recursos adicionales aunque sí será necesario un mayor
compromiso de cada uno de los grupos de profesionales implicados. En las
discusiones para su elaboración se ha hecho hincapié en la necesidad de mejorar
el software para los estudios de volumetría hepática y disponibilidad de
un moderno disector ultrasónico con terminales para cirugía abierta y
laparoscópica.
E. INDEPENDENCIA EDITORIAL
La elaboración de esta guía se ha realizado sin
ningún tipo de financiación interna o externa y los autores de la misma
manifiestan públicamente ausencia de conflicto de intereses.
F. AUTORES
Miembros
de la Sección Hepatobiliopancreática y Trasplante hepático:
-
A. Jiménez Bernadó
-
F.A. García Gil
-
E. Esteban Grau
-
E. Tejero Cebrián
-
P. Palacios Gasos
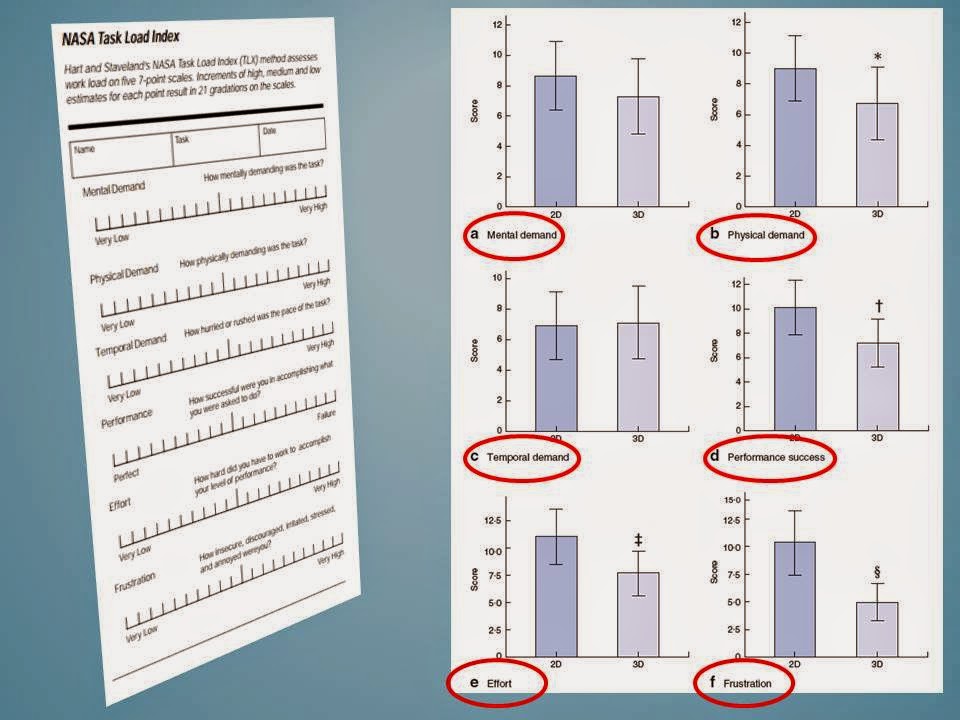
 ¿Cuáles
son las desventajas que para el cirujano ha supuesto esta pérdida de la visión
binocular?. Al tener que ver las imágenes en una pantalla plana 2D, el cirujano
tiene menor destreza en sus manos, desarrolla una mayor fatiga muscular, se
produce un claro aumento del stress y la mano no dominante pierde mucho
protagonismo. No obstante el cerebro humano es capaz de aprender y desarrolla
trucos para vencer la pérdida de la profundidad o tercera dimensión. Con una
curva de aprendizaje más o menos larga, según la destreza de cada uno, el
cerebro del cirujano comienza a interpretar las sombras, utiliza el paralelaje
en los movimientos y se nutre de la experiencia que va adquiriendo.
¿Cuáles
son las desventajas que para el cirujano ha supuesto esta pérdida de la visión
binocular?. Al tener que ver las imágenes en una pantalla plana 2D, el cirujano
tiene menor destreza en sus manos, desarrolla una mayor fatiga muscular, se
produce un claro aumento del stress y la mano no dominante pierde mucho
protagonismo. No obstante el cerebro humano es capaz de aprender y desarrolla
trucos para vencer la pérdida de la profundidad o tercera dimensión. Con una
curva de aprendizaje más o menos larga, según la destreza de cada uno, el
cerebro del cirujano comienza a interpretar las sombras, utiliza el paralelaje
en los movimientos y se nutre de la experiencia que va adquiriendo.